
锦秋A-Level学院作为隶属于新航道国际教育集团的高端子品牌,专为有志于申请英国G5及英澳高校的中学生设计,紧抓中国学生理科优势,进行课程组合化。开设数学、物理、化学、生物、经济学、会计学等课程,帮助学生以优异成绩申请更好的大学。
上次我们主要讲解covalent bond及ionic bond,今天我们来看一下Intermolecular force 中的Van der Waals’forces和Permanent dipole-dipole forces相关知识点。Intermolecular force中的Hydrogen bond我们下节再看。了解好Intermolecular force能够帮助我们更好的理解一些物质的性质。如沸点高低及同一物质不同状态的密度差别等。
今日所需单词
Intermolecular force 分子间力
Dipole 偶极
Non-polar 非极性的
Van der Waals’forces
像Ne和Ar等惰性气体以单个atom独立存在。它们能在很低的温度下被液化,因此它们atoms间一定有很弱的吸引力。这些力使它们在液体状态下,atoms结合在一起。
Br2在室温下是液体,它是non-polar molecule。这种微弱的吸引力使得室温下Br2保持液态。我们把这种微弱的吸引力叫做Van der Waals’ forces。Van der Waals’forces在所有atoms和molecules间都存在。
Non-polar molecule(或atom)中的电子电荷云一直在移动。所以有时,molecule的某端可能有更多的电荷云,导致在很短的时间内,一端带更多的负电,一个暂时的dipole就形成了。这个dipole可以感应相邻的molecules,因此一个molecule的dipole的δ+端和另一个molecule的dipole的δ-端间会有吸引力。因为电荷云一直在移动,所以这些dipoles都只是暂时的。我们有时也把Van der Waals’forces叫做 temporary dipole-induced dipole forces。
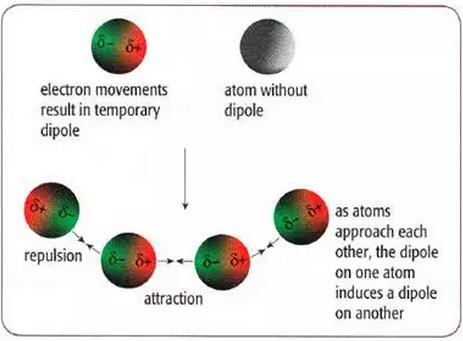
Van der Waals’forces会随着
a. Molecule中electrons(和protons)的增多而变大
b. Molecules之间结合点(结合点即molecules靠近的地方)的增多而变大
我们可以用Van der Waals’forces的大小差异来解释蒸发热(蒸发热即将1mol液体转换成1mol气体所需要的能量)和惰性气体的沸点。
·蒸发热和惰性气体的沸点随着electrons的增多而增大,因为atoms之间的Van der Waals’forces增大了。
·结合点的增多可以通过比较CH3CH2CH2CH2CH3和C(CH3)4的沸点。它们的electrons数量相同。 CH3CH2CH2CH2CH3中的molecules按线性结构排列,有很多结合点,因此它的Van der Waals’forces会更大,沸点也会更高。C(CH3)4molecules之间接触面积更小,结合点较少,Van der Waals’forces相对较低,因此沸点较低。
独立atoms之间的Van der Waals’forces非常小。但是像聚乙烯等非常长的non-polar molecules,它们的Van der Waals’forces很大。这也是为什么室温下的聚乙烯是固体。
Permanent dipole-dipole forces
在有一些molecule中,dipole是性的。而有性dipole的molecules,我们称之为polar molecules。它们能被充电的塑料棒或者梳子所吸引(塑料棒可以通过和羊毛布摩擦而感应生电)。不论带电的塑料棒是带正电或者负电,molecules都会被吸引。因为molecules既有正电极也有负电极。
两个带有性dipoles的molecules之间的力,我们称为permanent dipole-dipole forces。一个molecule的δ+和相邻一个molecule的δ-间有微弱的吸引力。
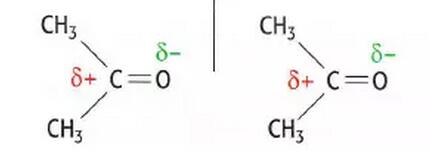
对于有同样数量electrons的小molecules,通常他们经历的permanent dipole-dipole forces会比Van der Waals’forces大。例如CH3COCH3比CH3CH2CH2CH3的沸点要高,即CH3COCH3比CH3CH2CH2CH3需要更多能量来破裂他们之间的分子间力。
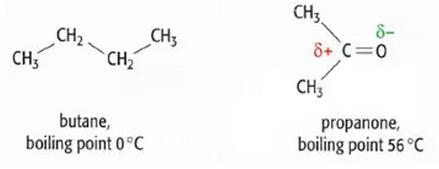
CH3COCH3 molecules间的permanent dipole-dipole forces大到足以使它在室温下保持液态。而CH3CH2CH2CH3间仅仅只有Van der Waals’forces,这种力相对来说比较弱,所以它在室温下处于气体状态。
锦秋A-Level与英国考试局Edexcel取得合作,在青岛、济南、武汉、长沙已获得考点授权,考点申请正在扩散全国多个城市。同时,与PICC合作,由PICC承保,学员投保后未能取得签约协议大学录取,则获相应赔偿金。完善的考务服务和便捷的考试安排,方便学生学、考结合,节约时间成本,全力冲刺G5。
| 大学名称 | QS排名 |
|---|